1 緒言
近年、デジタル技術やスマート製造を支えるIndustry 4.0の進展により、IoT・AIをはじめとするデータ駆動型生産システムが幅広い分野で実用化されつつある。さらに、次段階として提唱されるIndustry 5.0では、「人間中心」「持続可能性」「レジリエンス」を産業価値の新たな基盤と位置付け、従来の効率性重視の生産モデルから大きく転換する動きが進行している1-3)。また、カーボンニュートラルやSDGs(持続可能な開発目標)への取り組みが世界的に広がり、環境負荷低減・資源効率化・サーキュラーエコノミーの構築が喫緊の課題となる中、産業構造の変革がますます加速している4-6)。
こうした背景の中、さまざまな分野において製品の高機能化・複雑化が急速に進展している。例えば、自動車産業では軽量化や電動化ニーズの高まりから複合材料や新素材の開発が進んでいる。一方、材料特性の微細な構成要因依存性により、従来の単一物性測定では十分に評価できない事例が増加している。また、半導体・電子機器産業では超微細加工技術の進展とともに、品質変動や微細な欠陥を的確に検出し管理する技術が重要視されている。食品・医薬品産業でも、健康志向や食感、風味、使用感など、多様化する消費者ニーズに応えるために、従来の成分分析だけでは評価が難しい官能特性や微量成分の多面的評価が求められている。こうした複雑化・高機能化した製品の特性評価および品質管理のために、さまざまな先行研究や取り組みが行われてきた。たとえば、食品分野においては官能評価技術と化学分析を組み合わせたハイブリッドアプローチ7-9) や、AI・機械学習を活用した成分推定モデル10-12) などが提案されている。工業材料分野では、光学的・熱物性的手法による多角的評価13-15) や、ビッグデータ解析による異常検知システム16-18) が既に一部で実用化されている。しかしながら、こうした従来手法の多くは、それぞれの測定が特定の成分や単一の物性に焦点を当てているため、測定データの統合不足や、複数の因子間の相互作用を適切にモデル化する仕組みの欠如が課題として指摘されている。
本研究では、これらの課題に対して、蛍光プローブを基盤とする多次元解析システム「FLAIRS(Fluorescent Analysis with Inductive Recognition System)」を用いることで、新たな特性評価・品質管理手法の可能性を検証する。 FLAIRSの特徴は、特定の成分や物性に依存せず、試料に含まれる多様な情報を多次元データとして取得できる点にある。この多次元データを解析することで、試料全体の状態を網羅的かつ効率的に評価することが可能である。本研究では、食品における甘味評価、インクジェット材料の射出性評価、さらには医薬品の真贋判定を事例として取り上げ、FLAIRSが各分野の品質管理・特性評価における有効性を検証するとともに、今後の産業分野全般への応用可能性を示すことを目的とする。
2 実験
2-1. 測定システムFLAIRSの構築と測定
本研究では、液体試料の多次元的な物理化学的特性に起因するデータを取得・解析するため、蛍光分析技術を基盤としたシステム、「Fluorescent Analysis with Inductive Recognition System(FLAIRS)」を構築した。FLAIRSシステムは、励起光源、蛍光応答チップ(FLAIRSチップ)、光検出ユニット、および解析ソフトウェアで構成されている(Fig. 1)。励起光源には波長365nmのLEDを用い、蛍光応答チップ上の試料に均一に励起光が照射されるように設計した。これにより、試料と蛍光プローブ間の化学的相互作用が蛍光信号として取得可能となる。FLAIRSチップは、複数のウェルが配置された多孔構造を有しており、それぞれのウェルには異なる蛍光分子プローブが導入されている。これらのプローブは、試料中の成分やそれらの物理化学的特性に応答して構造を変化させることで、発光強度や発光色がほぼ連続的に変化するよう設計されている。これにより、試料の多様な物理化学的特性を高感度で反映する蛍光応答が得られる。測定プロセスでは、チップ上に規定量の試料を滴下し、一定時間静置することで蛍光信号の安定化を図った。その後、光検出ユニットを用いて各ウェルから発せられる蛍光信号を数百の多次元データとして取得した。
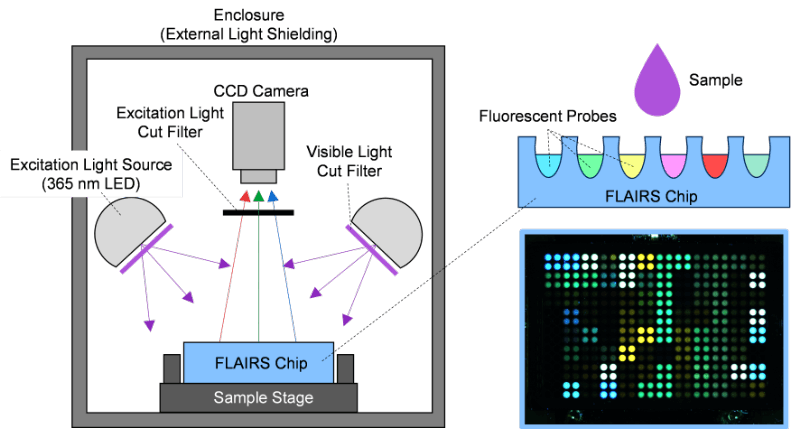
Fig. 1 Schematic of the FLAIRS (Fluorescent Analysis with Inductive Recognition System).
The sample is uniformly excited by a 365 nm LED light source, and chemical interactions on the fluorescence response chip are captured as fluorescence signals. The upper right shows the chip structure, while the lower right displays an actual measurement image of the fluorescence response chip.
2-2. データ分析
FLAIRSにより取得された多次元データに対し、適切な前処理を実施した。前処理では、各変数の分布や特性を把握するため、ヒストグラムや相関行列を用いてデータの可視化を行い、異常値や分布の偏りを確認した。その後、データの比較性を確保するために標準化(Zスコア変換)を行い、変数間のスケール差を除去した。標準化されたデータに対して主成分分析(PCA)を適用し、次元削減を実施するとともに、データ構造の可視化および主要因の特定を行った。また、回帰分析には部分的最小二乗回帰(PLS回帰)を採用し、独立変数(FLAIRSデータ)と従属変数(目的に応じた評価指標)の関係を解析した。
2-3. エクソソーム試料の調製と評価
エクソソームの損傷状態の可視化を目的として、コスモ・バイオ株式会社より購入したウシ由来ミルクエクソソーム(品番:EXBM1000L)を使用した。エクソソームの粒径はNanoSight LM10を用いて測定した結果、平均200 nmであることが確認された。また、エクソソームの表面マーカー(CD9、CD63、CD81)については、ウェスタンブロット法により解析を行い、CD9およびCD81のバンドを確認した一方で、CD63のバンドは検出されなかった(販売元提供データに基づく)。エクソソーム試料は1×PBS(Phosphate Buffered Saline)で10倍希釈後、小分け分注(計20チューブに分注)し、以下の保存および処理条件(計7条件)に基づいて調製した。保存条件は販売元が推奨する4℃を基本とし、調製した試料を4℃(冷蔵保存、対照群)、25℃(常温保存)、37℃(生理的温度条件)、60℃(高温ストレス条件)の4つの温度条件で17日間保存した。その後、すべての試料を1日間4℃で保管(計18日間)し、N=9(60℃のみN=6)の条件でFLAIRS測定システムを用いて損傷状態を評価した。凍結融解条件については、-80℃で凍結した試料を室温で完全に融解させることを1回の凍結融解操作と定義した。未処理条件(0回)は調製後18日間4℃で保存した。凍結融解1回条件では、試料を一度-80℃で凍結し、測定時に解凍した。凍結融解5回条件では、試料を-80℃で凍結後、室温で解凍する凍結融解操作を4回実施し、その後再び-80℃で保存した後、測定時に解凍した。凍結融解10回条件では、試料を-80℃で凍結後、室温で解凍する凍結融解操作を9回実施し、その後再び-80℃で保存した後、測定時に解凍した。すべての試料はN=9(60℃条件のみN=6)の条件で調製を行い、それぞれに対してFLAIRSを用いた測定を実施した。得られた多次元データは視覚的な解析を目的として、適切な手法を用いて可視化を行った。また、同一の試料に対して、NanoSight LM10(Malvern Panalytical社製)によるエクソソームサンプル中の粒子サイズ分布および濃度の測定を行った。
2-4. 医薬品の真贋判定
FLAIRSを用いて、肥満治療薬Xenical(有効成分:オルリスタット120mg)の真薬および偽造薬の真贋判定を試みた。Xenicalは脂肪吸収を抑制する作用を有し、肥満の治療および体重管理に用いられる医薬品である。真薬および偽造薬は外部の研究機関から提供を受けたものであり、偽造薬は実際に海外市場で流通していたものである。これらの偽造薬には、有効成分が基準濃度に達していないものや、有効成分が真薬と異なるものが含まれている。また、真薬および偽造薬のいずれも複数のロットが提供され、それぞれを独立した試料として扱い解析を行った。提供された試料は錠剤の形状で受領し、乳鉢を用いて粉砕後、適切な濃度で溶媒(ジメチルスルホキシド:DMSO)に溶解した。溶解後、試料を遠心分離し、得られた上澄み液を測定試料として使用した。FLAIRSによる測定は、各試料から得られる多次元データを基に実施された。取得したデータに対してPCAを適用し、真薬および偽造薬のデータを可視化した。さらに、真薬のデータのみを用いてPCAに基づく学習を行い、その特徴成分から大きく逸脱するものを偽造薬と判定するモデルを構築し、実際に真薬および偽造薬を判別することが可能であるか検証した。
2-5. インクジェット射出液の調製と評価
インクジェットヘッドを用いたポリウレタン系樹脂分散体の射出性について、FLAIRSを活用した予測可能性を検討した。試料として、外部で試作された複数のポリウレタン系樹脂分散液を使用した。これらの試料は水を基材とし、分散している樹脂の合成プロセスが各ロット間で異なる一方で、外部試料であるため具体的な組成や配合比については不明である。本研究では、顔料や添加剤を含まない樹脂分散液単体を対象とし、射出性の評価を実施した。射出試験には自社製インクジェットヘッドを使用し、基準電圧による駆動を行った。射出性の評価は事業部の協力を得て実施し、射出された液滴の形成挙動を観察した。主軸のブレやサテライトの分散状態、Air Ingestion Limit(AIL)時の射出速度、および液滴形成の安定性を指標として評価を行い、液滴の主軸ブレがほとんどなく、サテライトの散乱が少ないうえにAIL時の射出不良が観察されない試料を射出性○と評価した。一方で、AIL時の射出速度が低下する、サテライトの散乱が多い、または液滴形成が不安定である試料を射出性×として分類した。これらの試料に対してFLAIRS測定を実施し、得られた多次元データに適切な前処理を施した後、PCAを用いてデータの可視化を行った。射出性○および×の試料間の分布の違いがPCA空間上で分離可能であるかを検証し、FLAIRSデータを用いた射出性予測の実用性を評価した。
2-6. オレンジジュース試料の甘味評価と予測
オレンジジュースに添加された多糖類が甘味に与える影響を、FLAIRSを用いて予測できるか検証を行った。試料は外部の食品メーカーより提供され、基準となるオレンジジュースに加え、3種類の多糖類(A、B、C)のいずれかを濃度範囲0.05~0.3%(0.05%刻み)で添加したサンプルが用意された。なお、外部サンプルであるため、多糖類の具体的な種類や詳細な組成については明かされていない。甘味の定量化には官能評価(QDA:定量的記述分析法)を用い、パネリスト3名により、基準試料(オレンジジュース単体)の甘味を0とし、多糖類添加による甘味の変化を-3(大幅に減少)から+3(大幅に増強)までの7段階で評価した。評価は多糖類の種類のみを明示し、濃度は伏せた状態で、色や外観が見えない容器を用いて実施された。これらの試料について、FLAIRSによる測定を行った。得られた多次元データを用いてPCAによる可視化を行った後、PLS回帰による甘味の予測を行った。PLS回帰では、官能評価で得られた甘味スコアを目的変数、FLAIRSデータを説明変数としてモデルを構築した。クロスバリデーションにより最適なコンポーネント数を3と決定し、データをトレインデータおよびテストデータに分割してモデルを学習、検証した。予測性能の評価は、実測値と予測値の関係を予測値-実測値プロットとして示し、複数回のデータ分割および検証結果を統合して解析を行った。
3 結果と考察
3-1. エクソソームのダメージ可視化
3-1-1. 凍結融解の繰り返しによる損傷
エクソソームは、直径40~200nm程度の小型の細胞外小胞であり、多くの細胞が分泌することが知られている19-21)。その主な構造は脂質二重膜で囲まれており、内部にはタンパク質、核酸(RNAやDNA)、脂質などの分子を含む。現在、その特性を活かした応用研究が進んでいる。医療分野では再生医療や診断マーカー、薬剤送達システムへの応用が期待されているほか、美容分野では肌の再生促進や炎症の緩和を目的とした化粧品成分としての活用が注目されている。また、食品や農業、ペットケアなど異分野への応用可能性も広がっており、エクソソームは次世代の革新的技術として多くの分野での展開が期待されている。しかし、その繊細な構造ゆえ、保存状態によって損傷を受けることが課題となっている。本研究では、エクソソームの膜構造への影響が強い凍結融解の繰り返しと保管時の温度による損傷について、FLAIRSによる可視化の検討を行った。
エクソソームは、一般にその構造的安定性を保つため4℃、または-80℃で保管されることが多い。これは、低温環境が膜構造の変性を抑え、内部成分の漏出や分解を防ぐためである。長期保存や輸送の必要性から、より一般的には-80℃で凍結保存されることが多い。しかし、凍結保存はエクソソームの劣化を抑える利点がある一方で、凍結融解操作を繰り返すと、氷晶形成や膜への物理的ストレスにより、膜の破壊やタンパク質の変性、さらには内容物の漏出が生じることが知られている22-24)。これらの損傷は通常、透過型電子顕微鏡(TEM)やナノ粒子追跡解析(NTA: Nanoparticle Tracking Analysis)を用いて評価される。TEMではエクソソームの形態や膜の連続性を観察し、損傷を直接検出することが可能である25, 26)。一方、NTAは粒子径の変化や凝集の進行を測定し、間接的に損傷を評価する手法である27, 28)。また、動的光散乱(DLS)を用いた粒子サイズ分布の測定や、ゼータ電位測定による表面電荷密度の評価も、保存温度がエクソソームの安定性を示す指標として活用される29)。しかしながら、これらの手法はそれぞれが提供する情報に限界があり、複数の手法を組み合わせて評価を行う必要がある。一方で、複数の手法を用いることは、測定手順が複雑化し、前処理や装置操作に高い技術的スキルを要するため、実験運用において技術的な制約となる場合がある。
本研究では、新たに開発された測定システムFLAIRSを用いて、凍結融解操作によるエクソソーム損傷の可視化を試みた。FLAIRSは、分析物の特性を多次元的に取得可能なシステムであり、従来の評価手法を補完するツールとして期待される。複数の凍結融解条件下で処理したエクソソーム試料をFLAIRSで測定し、得られた多次元データを基にPCAを実施した。PC1とPC2をそれぞれ横軸および縦軸とする散布図をFig. 2に示す。プロットには、凍結融解回数に応じた色の濃淡を付与している。PCAの結果、PC1の寄与率は33.5%、PC2は27.5%であり、これら2成分で全体の分散の61.0%を説明することができた。凍結融解回数ごとにプロットが異なる領域に分布しており、回数に応じたクラスの分離が確認された。特にPC2方向では、凍結融解回数の増加に伴い、プロットが順序性を持って顕著に移動していることが観察された。0回および1回の試料では、PC2の値が低く、プロットが比較的近接して分布している。一方、5回および10回の試料では、PC2方向の値が高くなり、特に10回の条件では最も高い位置に集中している。つまり、PC2方向が凍結融解操作による損傷の進行度を反映している可能性を示していると考えられる。この結果の妥当性を検証するため、同一サンプルに対してNanoSight LM10によるエクソソームサンプル中の粒子サイズ分布および濃度を測定した。その結果、予想通り、凍結融解の繰り返しによって粒子の凝集が生じ、400 nm程度の粒子が増加していることが確認された(Fig. 3)。また、凍結融解の回数が増加するにつれて粒子濃度が減少する傾向が見られた(Fig. 4)。これは、凝集により粒子としてカウントされる数が減少していることや、エクソソームの分解によってNanoSight LM10が測定できない80 nm以下の構造に変化していることが起因すると推察される。凍結融解回数が0回から1回で粒子濃度が増加しているのは、凍結融解によりエクソソームが一部崩壊しているために粒子としてカウントされる数が増加しているためであると考えられる。
したがって、PC2方向の変化は、凍結融解回数の増加に伴うエクソソーム膜の不安定化、凝集、または内部成分の漏出といった損傷に関連していると考えられる。また、PC1方向においても凍結融解回数に応じた変化が観察されたが、その影響はPC2ほど顕著ではなかった。これらの結果から、FLAIRSは凍結融解操作によるエクソソームの損傷状態を多次元的かつ定量的に評価できる有用な手法であることが示された。
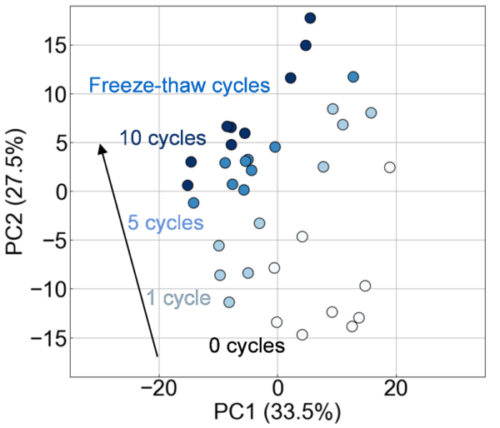
Fig. 2 PCA plot of exosome samples. The distribution along PC1 (33.5%) and PC2 (27.5%) shows class separation, with damage progression due to increasing freeze-thaw cycles clearly reflected along the PC2 axis.
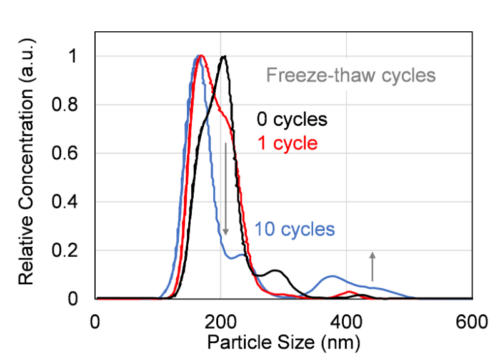
Fig. 3 Changes in exosome particle size distribution with increasing freeze-thaw cycles, measured using NanoSight LM10. Repeated freeze-thaw cycles result in particle aggregation around 400 nm, indicating progressive structural damage to the exosomes.
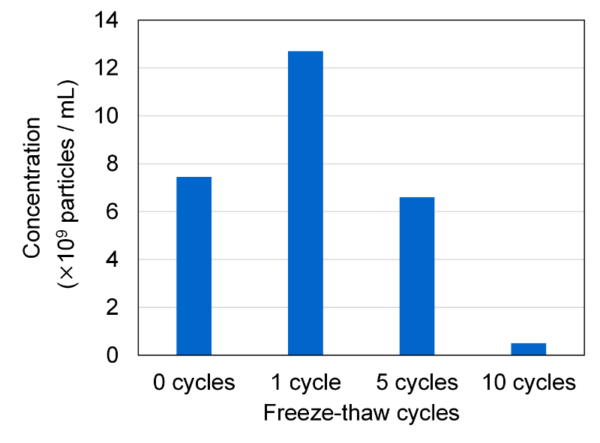
Fig. 4 Changes in exosome particle concentration with increasing freeze-thaw cycles, measured using NanoSight LM10. Particle concentration decreases with more freeze-thaw cycles, indicating advanced particle aggregation.
3-1-2. 保管時の温度上昇による損傷
次に、エクソソームの保管温度が損傷に与える影響を検討した。エクソソームは保存温度の上昇に伴い、膜構造の不安定化、タンパク質の変性、リン脂質二重膜の流動性増加などが進行し、それにより膜の破壊や内部成分の漏出、さらにはエクソソーム間の凝集が引き起こされることが知られている30-32)。
本研究では、複数の温度条件下で保存したエクソソーム試料をFLAIRSで測定し、得られた多次元データを基にPCAを実施した。PC1およびPC3をそれぞれ横軸、縦軸とする散布図を作成し、プロットには保存温度に応じた色の濃淡を付与した(Fig. 5)。この結果から、保存温度ごとにプロットが明確に分離され、特性の変化が主成分空間上で順序性を持って表現されていることが確認された。特にPC1は保存温度の上昇に伴い顕著な変化を示し、温度が4℃から60℃へと上昇するにつれてプロットが正の方向へ連続的に移動する傾向が認められた。このことは、PC1がエクソソームの損傷の進行度を反映し、特に高温条件下でのダイナミックな変化を捉えていることを示唆している。一方、PC3は4℃および25℃の条件でのプロットの分離が顕著であり、低温条件におけるエクソソームの微細な特性変化を反映していると考えられる。これらの結果は、PC1が保存温度の大きな変化に伴う損傷を示す一方で、PC3が低温条件における微細な変化を識別する指標となり得ることを示している。具体的には、PC3における4℃と25℃の分離は、低温環境下でもエクソソーム表面の微細な構造的または化学的変化が進行している可能性を示し、PC1方向での変化は、特に37℃および60℃といった高温条件でエクソソームの構造的安定性が大きく損なわれることを反映していると考えられる。
この結果の妥当性を検証するため、同一サンプルに対してNanoSight LM10によるエクソソームサンプル中の粒子サイズ分布および濃度を測定した。より高温域においては凝集に起因した300-400 nm程度の粒子増加が確認された一方、低温域では明確なサイズ分布の変化が認められなかった(Fig. 6)。また、凍結融解の回数が増加するにつれて粒子濃度が増加する傾向が見られた(Fig. 7)。これは、NanoSight LM10では80 nm以下の粒子は測定できないため、加温により80nm以下の粒子が凝集し、カウントされる粒子濃度が増えていると考えられる。
これらの結果から、FLAIRS測定システムはエクソソームの保存温度による損傷状態を多次元的かつ包括的に評価可能であることが示された。
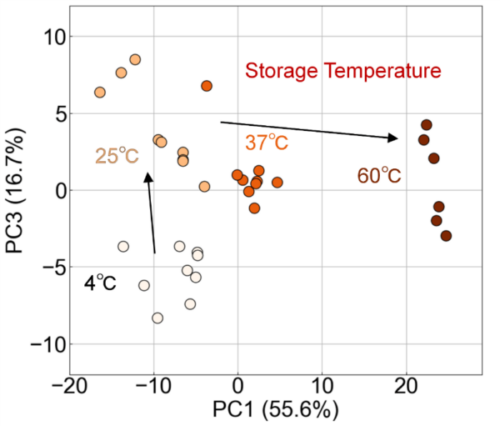
Fig. 5 Evaluation of exosome damage due to storage temperature using PCA analysis. The scatterplot along PC1 (55.6%) and PC3 (16.7%) shows significant damage progression with increasing temperature along the PC1 axis. Additionally, PC3 reflects subtle changes in exosome properties under low-temperature conditions (4°C and 25°C).
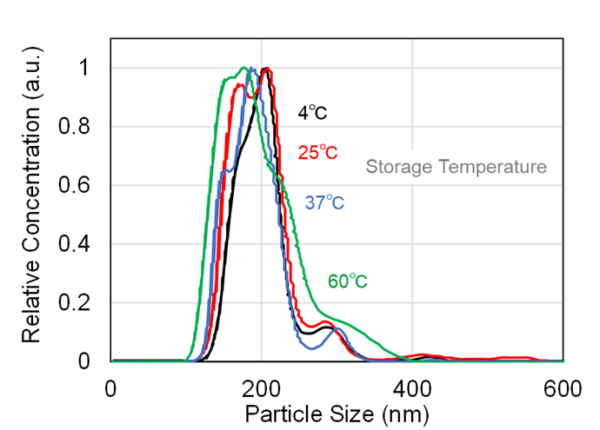
Fig. 6 Particle size distribution of exosomes stored at various temperatures (4, 25, 37, and 60℃), measured using NanoSight LM10. At higher storage temperatures (60℃), an increase in particle size around 300–400 nm was observed, suggesting aggregation, whereas no significant change in size distribution was detected at lower temperatures.
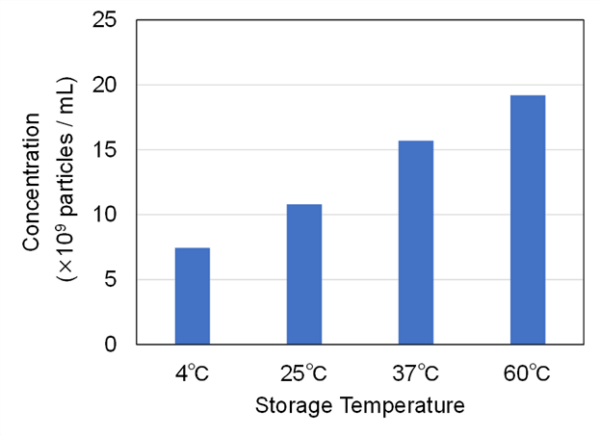
Fig. 7 Particle concentration of exosomes stored at various temperatures (4, 25, 37, and 60℃), measured using NanoSight LM10.
3-1-3. 損傷要因の分離
FLAIRSによって凍結融解の回数および保存温度がエクソソームの損傷に及ぼす影響を個別に評価可能であることが示唆されたが、これらの損傷要因を区別可能であるか検証を行った。FLAIRSによって測定された全条件の多次元データに対してPCAを適用し、その結果をFig. 8に示す。この散布図は、PC1~PC3で構成された3次元空間を特定の平面に投影したものであり、Basis 1およびBasis 2を軸として可視化している。PCAの結果、PC1、PC2、PC3の寄与率はそれぞれ52.1%、15.6%、9.9%であり、これら3つの主成分で全体の分散の77.6%を説明できることが示された。Basis 1およびBasis 2は、これらの主成分の線形結合として定義され、それぞれ以下の式で表される。
Basis 1 = -0.87×PC1 + 0.50×PC2 + 0.05×PC3
Basis 2 = -0.33×PC1 – 0.49×PC2 – 0.80×PC3
これらの軸は、保存温度および凍結融解回数がエクソソームの特性に及ぼす影響を効率的に分離して反映できるよう設計されている。Basis 1は保存温度の影響を主に反映し、Basis ②は凍結誘拐回数の影響を強調するような情報空間である。
Fig. 8より、保存温度および凍結融解回数による損傷が主成分空間上で独立して識別可能であることが確認された。保存温度の影響は主にBasis 1方向に反映されており、温度が4℃、25℃、37℃、60℃の順にプロットが左方向へ移動する傾向を示した。したがって、高温条件ほどエクソソームの構造的安定性が損なわれ、損傷が進行していることを示唆している。一方、凍結融解回数の影響は主にBasis 2方向に反映されており、凍結融解回数が増加するにつれてプロットが上方向へ移動している。この傾向は、繰り返しの凍結融解操作が膜構造の破壊や内部成分の漏出など、多様な損傷を引き起こしている可能性を示している。温度変化による損傷は、膜タンパクやリン脂質二重膜の構造変化、表面電荷の変化、および凝集が主な要因であると考えられる。一方、凍結融解操作では、エクソソームの崩壊や凝集、内部成分(核酸やタンパク質)の漏出といった現象が主に影響していると考えられている。このため、保存温度と凍結融解回数がエクソソームに与える影響は異なる挙動を示すと推察される。従来法では、TEMや粒径測定、ゼータ電位測定などを組み合わせることでこれらの現象の一部を評価可能であるが、測定範囲が限定される点や局所的な情報に留まる点が課題である。
今回の結果から、FLAIRSを用いることで、保存温度と凍結融解回数という異なる損傷要因を主成分空間上で独立して評価できることが示された。特に、Basis 1およびBasis 2の軸が保存および取り扱い条件に応じた損傷を区別する指標として有効であることが明らかとなり、FLAIRSがエクソソームの保存および処理条件の最適化に向けた有力な評価手法となる可能性を示唆している。本検証では、これまでは高度な測定を複数組み合わせることで推察していたエクソソームの損傷状態を、FLAIRSという一つのシステムで可視化できるという新たな評価法の入り口に立てた。今後は、実際の保存条件や処理プロセスをより現実的に反映した試験系での検証を進め、FLAIRSの応用範囲を広げることが課題である。また、損傷要因が相互に複雑に絡み合った場合の識別能力の検証や、FLAIRSによる測定データをもとにした具体的な保存プロトコルの提案など、さらなる実用化に向けた研究が求められる。
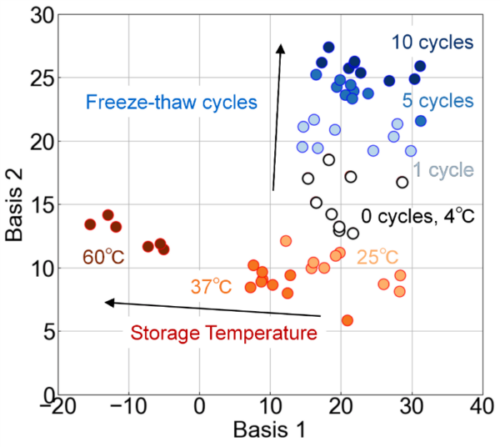
Fig. 8 Evaluation of the effects of storage temperature and freeze-thaw cycles on exosome properties using PCA analysis. Basis 1 primarily reflects the impact of storage temperature, while Basis 2 emphasizes the effects of freeze-thaw cycles. Storage temperature conditions (4℃, 25℃, 37℃, 60℃) were evaluated with no freeze-thaw cycles (0 cycles), and freeze-thaw conditions (1 cycle to 10 cycles) were evaluated at a fixed temperature of 4℃. With increasing storage temperature, plots shift to the left along Basis 1, and with more freeze-thaw cycles, plots move upward along Basis 2, demonstrating that these factors can be independently identified in the principal component space.
3-2. 医薬品の真贋判定
3-2-1. 医薬品真贋判定におけるFLAIRSの基礎評価
医薬品の偽造問題は、特に国際市場で深刻な課題となっている33-35)。偽造薬は、有効成分の欠如や濃度不足、不純物の混入による患者の健康被害を引き起こすだけでなく、正規医薬品の信頼性を損なう要因となる。本研究では、肥満治療薬であるXenical(有効成分:オルリスタット120 mg)を対象に、真薬および偽造薬の真贋判定を試みた。Xenicalは、消化酵素リパーゼを阻害し、脂肪吸収を抑制する作用を有する薬剤であり、体重管理に広く使用されている。
現在、医薬品の真贋判定には高速液体クロマトグラフィー(HPLC)やラマン分光法が用いられる36-39)。HPLCは不純物プロファイルを分析する手法であり、特定の成分の分離と定量に優れているが、プロファイルが異なる製品間での判別が難しいという課題がある。一方、ラマン分光法は非破壊的に物質の化学構造を解析可能であり、特に医薬品錠剤の表面分析に適しているが、高額な装置コストや専門的なデータ解析スキルが必要であり、類似成分を含む偽造薬の識別が困難である場合もある。特に、偽造品製造者がラマン分光法に基づく検査を回避するために成分を調整する場合、この技術の有効性が低下する可能性がある。FLAIRSは、複数の蛍光プローブを用いて試料中の網羅的な物理化学情報を取得する技術であり、取得されたデータは特定の物理量に依存せず、それ単体では解釈性がないため、既存技術の課題を克服する可能性を有している。本研究では、FLAIRSを用いた真贋判定における有効性を検証した。
Fig. 9に、FLAIRSを用いて得られたデータをPCAにより可視化した結果を示す。PC1およびPC2の寄与率はそれぞれ50.0%および30.0%であり、これら2つの主成分で全データの80.0%を説明可能であった。PCAプロットでは、真薬(Real Drug)と偽造薬(Counterfeit Drug)が明確に分離しており、FLAIRSが真薬と偽造薬の特性差異を検出できることが示された。また、偽造薬のデータは真薬とは異なる分布を示すとともに、偽造薬間にばらつきが見られた。これは、偽造薬ごとに製造プロセスや成分組成が異なることを反映していると考えられる。
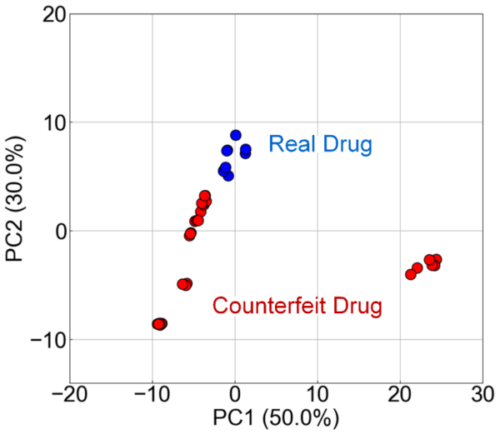
Fig. 9 PCA analysis of real and counterfeit drugs using FLAIRS. The scatterplot along PC1 (50.0%) and PC2 (30.0%) demonstrates clear separation between real drugs (Real Drug) and counterfeit drugs (Counterfeit Drug), indicating the high accuracy of FLAIRS in detecting characteristic differences. The variation in counterfeit drug distribution reflects differences in manufacturing processes and compositions among samples.
3-2-2. 真薬および偽造薬の判定モデル構築と性能検証
次に、FLAIRSを用いて取得したデータに基づき、真薬および偽造薬の判定を行うモデルを構築した。まず、真薬54サンプルを学習データとして用い、PCAを適用した。主成分数は累積寄与率が80~90%に達する範囲で最適化し、得られた主成分スコアを基に復元誤差(Reconstruction Loss)を算出した。この復元誤差は、試料の特徴がPCAによるモデルでどの程度再現されるかを示す指標であり、真薬のデータに対しては低い誤差が得られることが期待される。一方、偽造薬は真薬の特徴から統計的に逸脱しているため、復元誤差が高くなると考えられる。真薬データの復元誤差分布をガンマ分布にフィッティングし、その分布に基づいて正常範囲を示す閾値を設定した。
検証データとして、学習データには含まれていない6サンプルの真薬および12サンプルの偽造薬データを用いた。各データの復元誤差を算出し、設定した閾値と比較した結果、真薬の復元誤差は正常範囲内に収まり、偽造薬の復元誤差は閾値を超えることが確認された(Fig. 10)。この結果は、偽造薬が真薬の特徴から逸脱していることを示しており、FLAIRSで取得された多次元データが真薬と偽造薬の識別に有効であることが示唆された。
これらの結果を基に、真贋判定の精度を混同行列(Confusion Matrix)により評価した結果、真薬および偽造薬は完全に分離され、誤判定は確認されなかった(Fig. 11)。具体的には、6サンプルの真薬がすべて「真薬:Real Drug」と正しく判定され、12サンプルの偽造薬はすべて「偽造薬:Counterfeit Drug」と判定された。このことから、FLAIRSは真薬と偽造薬の微細な差異を高精度に検出できることが示された。
本研究では、真薬の復元誤差分布を基に閾値を設定したが、実際の異常検知の場面では目的に応じて閾値を調整することで、偽陽性と偽陰性のバランスを柔軟に制御できる。例えば、偽陰性(異常を見逃すリスク)を低減するために閾値を厳格に設定する場合や、偽陽性(正常品を誤って異常と判定するリスク)を抑制するために閾値を緩和する場合など、運用目的に応じた適用が可能である。
さらに、FLAIRSは真薬と偽造薬の判定に留まらず、製造物における未知の異常検出にも応用できる点が特徴である。従来の異常検知技術は、成分分析や特定の物理量に依存するため、事前に設定した基準や対象範囲内でしか異常を検出できないという限界がある。また、特定の基準を回避するよう調整された製品や、従来の想定を超えた異常が発生する場合には、その検出性能が低下する可能性がある。一方、FLAIRSは蛍光プローブを用いて試料の多次元的かつ網羅的なデータを取得するため、事前に異常の種類や発生要因を想定せずとも高い検出性能を発揮する。特に、製造工程における予期せぬ成分混入、物性変化、プロセス不具合、あるいは製品の劣化といった幅広い異常の識別に有用である。FLAIRSが取得するデータは統計的な特徴を基に解析されるため、単純な成分調整やプロファイル改変による回避が困難であり、従来技術では検出が難しい微細な異常や未知の異常をも捉えることができる。
以上の結果から、FLAIRSは医薬品の品質管理や偽造薬の検出に加え、製造物全般の品質保証や異常検知の分野においても柔軟に適用できる有用なツールであることが示された。従来技術を補完・代替しうる高い実用性を有し、今後はさまざまな製造業における品質管理や異常監視への応用が期待される。
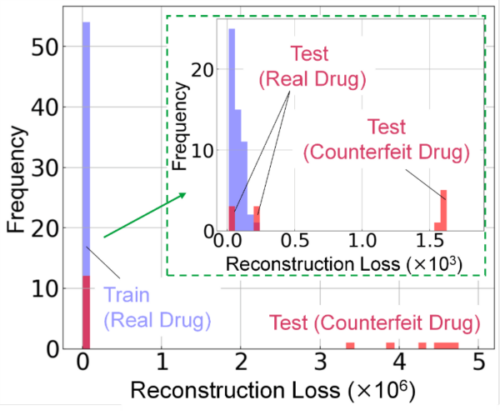
Fig. 10 Histogram showing the reconstruction loss distribution for real and counterfeit drug data. The reconstruction loss for real drugs falls within the normal range, while counterfeit drugs exhibit losses exceeding the threshold. The inset (green box) highlights details of the low-loss region, demonstrating the ability to distinguish between real and counterfeit drugs.
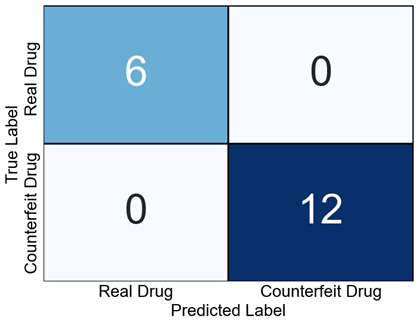
Fig. 11 Confusion matrix showing the classification results for real and counterfeit drugs. All real and counterfeit drugs were correctly classified with no misclassifications, demonstrating the high accuracy of FLAIRS in authentication.
3-3. インクジェットの射出性予測
インクジェット材料の射出性は、粘度や表面張力、分散安定性といった多様な物理化学的特性に依存するため、単一の物性値のみでは射出挙動を正確に予測することは困難である40-42)。従来、射出性の評価には実際にインクジェットヘッドを用いた試験が不可欠であるが、これには多大な時間と労力を要し、開発効率の低下を招いていた。
本研究では、樹脂分散体の射出性予測について、FLAIRSによる予測可能性を検討した。外部試作の樹脂分散液を対象にインクジェットヘッドで射出試験を実施し、液滴形成挙動に基づき射出性を「Good(○)」および「Poor(×)」に分類した。これらの試料に対してFLAIRS測定を行い、取得した多次元データを前処理後、PCAで可視化した。Fig. 12に、得られた主成分を基に定義されたBasis 1およびBasis 2平面に射出性○(Good)および×(Poor)の試料をプロットした結果を示す。Basis1およびBasis2は、これらの主成分を線形結合して以下の式で定義された。
Basis 1 = -0.24×PC1 – 0.66×PC2 + 0.71×PC3
Basis 2 = -0.28×PC1 + 0.66×PC2 – 0.70×PC3
この結果から、射出性○の試料が収まる領域には一定の狭い範囲が存在し、この範囲を外れる場合、液滴形成挙動が不安定になる可能性が示唆された。FLAIRSによる統計空間上の分離は、射出性に関連する複合的な物性情報を反映しており、従来の単一の物性指標(例:粘度)だけでは捉えられなかった違いを包括的に可視化できることを示している。また、PCA自体は教師なし学習であるが、射出性の評価結果を付与することで、統計空間上で明確な区別が可能となった。この手法により、FLAIRSは射出性予測や試料評価の効率化に寄与することが期待される。
さらに、FLAIRSを用いた統計的手法は、詳細な組成が不明な試料に対しても有効であり、試料間の射出性の差異を迅速に評価できる点で優れている。これにより、従来の実射出試験の手間を削減し、開発初期段階におけるスクリーニングツールとしての有用性が示唆された。また、射出性に影響する要因が多岐にわたることから、FLAIRSの多次元解析は射出性評価のみならず、異常検出や試料の最適化にも応用可能であると考えられる。これらの結果から、FLAIRSはインクジェット材料の射出性評価において従来の試験を補完・代替し、効率的な開発プロセスを支援する有用なツールとなることが示された。また、インクジェット材料に限らず、原料の混合や複合材料の特性が製品性能に大きく影響する他の製品分野、例えば化粧品、食品、塗料、接着剤といった産業分野でも、複雑な物性特性の把握や異常検出においてFLAIRSが有用である可能性が示唆された。
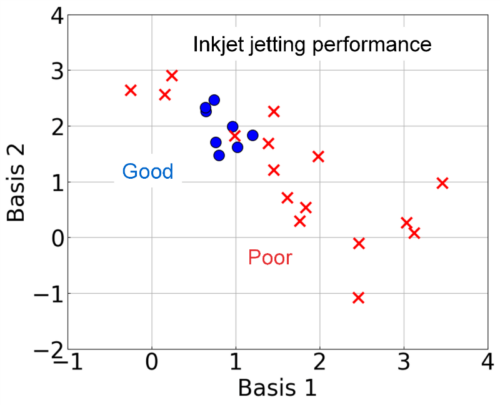
Fig. 12 Evaluation of inkjet material jetting performance using FLAIRS. In the statistical space of Basis 1 and Basis 2, samples classified as “Good (○)” and “Poor (×)” are clearly separated. “Good” samples are concentrated in regions with low Basis values, while “Poor” samples are distributed in regions with high Basis values. These findings indicate that FLAIRS effectively captures differences in physicochemical properties related to jetting performance and distinguishes between samples statistically.
3-4. 多糖類の添加によるオレンジジュースの甘味変化予測
現在、多くの飲料製品では口当たりの向上やテクスチャの調整を目的として微量の多糖類が添加されることが多い43-45)。多糖類そのものにはほとんど甘味が感じられない一方で、飲料に含まれる糖由来の甘味に影響を与えることが知られており、甘味を増強またはマスキングすることで、味の感じ方が変わる副次的な効果が生じる。このような甘味の変化は、従来の糖度計などの物理的測定では捉えることができず、最終的には官能評価に依存せざるを得ないという課題がある。本研究では、FLAIRSを用いて多糖類の添加が甘味に与える影響を定量的に予測できるかを検証した。
FLAIRSデータに基づきPCAを実施し、試料の分布とグループ化を可視化した。Fig. 13にPCAの結果を示す。PC1とPC2は、それぞれ全分散の56.4%および22.8%を説明した。多糖類が添加されていない試料(No Additives)は、多糖類を含む試料と明確に区別された。また、多糖類を含む試料についても、多糖類A、B、Cの3つの異なるクラスターに分かれた。この明確な分離は、FLAIRSが多糖類の種類や濃度によるスペクトルの違いを的確に捉えていることを示唆している。
次に、官能評価スコアを目的変数とし、FLAIRSで取得した多次元データに対してPLS回帰を適用した。モデルの構築にはクロスバリデーションを用いて最適な成分数を決定し(3成分)、トレーニングデータおよびテストデータに分割してモデルの評価を行った。Fig. 14に、実測値と予測値の比較結果を示す。トレーニングデータ(青色)およびテストデータ(オレンジ色)の分布は、理想線(実測値=予測値)に対して良好に一致しており、甘味スコアの予測性能が高いことが確認された。また、トレーニングおよびテストデータにおいて顕著な外れ値は観察されず、モデルの汎化性能も良好であることが示された。これは、FLAIRSが多糖類添加によるオレンジジュースの甘味の変化を統計的に反映し、官能評価スコアとの高い相関を示すことを意味する。従来の物性測定では検出困難であった甘味の微細な変化についても、FLAIRSによる多次元データ解析により包括的かつ高精度に評価可能であることが示された。
さらに、多糖類の種類や濃度が異なる複数の試料を対象とした本検証において、PLS回帰モデルが一貫して高い予測性能を示したことは、FLAIRSが甘味予測や品質管理ツールとして有用であることを示唆している。これにより、官能評価の補完手段としての役割が期待され、製品開発段階における効率化および客観的な品質管理への応用が可能となる。
以上の結果から、FLAIRSは甘味の定量的な予測に留まらず、今後、風味や質感といった他の官能評価項目への適用も期待される。これにより、食品開発分野における多面的な品質管理および製品最適化への展開が期待される。
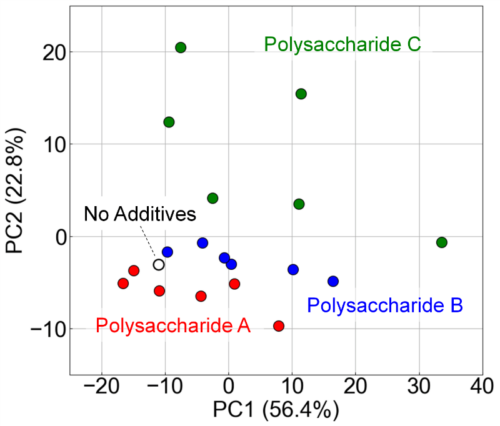
Fig. 13 Visualization of the impact of polysaccharide additives on orange juice properties using PCA analysis. Along the principal components PC1 (56.4%) and PC2 (22.8%), samples without additives (No Additives) are clearly distinguished from those with polysaccharides, while samples containing polysaccharides A, B, and C form distinct clusters.
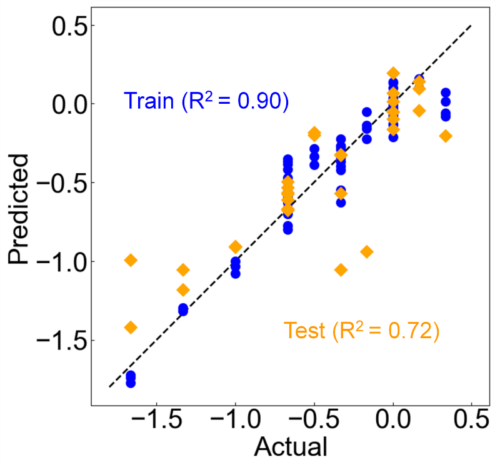
Fig. 14 Results of the PLS regression model predicting the effect of polysaccharide additives on sweetness scores. The scatterplot of actual versus predicted values shows that the training data (blue) and test data (orange) align well with the ideal line (actual = predicted), confirming the high performance of the prediction model using FLAIRS.
4 結言
本研究では、FLAIRSを用いた多次元データ解析技術の有用性を、医薬品、化学材料、食品を含む多岐にわたる分野で検証し、その実用性を具体的に評価した。医薬品や化学材料では、従来複数の高度な測定を必要としていた評価を、FLAIRSの多次元データ解析により効率的に代替できる可能性が示された。また、食品分野では、官能評価に依存していた主観的な判断を、より客観的な分析に置き換える可能性を確認した。このように、FLAIRSは従来手法では困難であった特性の解析を可能にし、品質管理や製品開発の効率化に貢献することが期待される。さらに、その汎用性と柔軟性により、幅広い産業分野への応用が期待される。
さらに、FLAIRSが持つ多次元データ取得能力は、従来の「測定」に留まらず、産業と社会の未来を切り開く「データ駆動型基盤技術」としての可能性を秘めている。たとえば、環境分野では、再生可能素材の開発やリサイクル技術の効率化、医療分野では、個別化医療や新たな診断基準の策定、さらには食品産業における多面的な品質評価の標準化など、多岐にわたる課題の解決に貢献し得る。これらの応用は、Industry 4.0からIndustry 5.0へと進む次世代の産業モデルにおいて重要な役割を果たすだろう。
しかしながら、FLAIRSを本格的に実用化するには課題も残されている。特に、測定装置のユーザビリティー向上や、解析アルゴリズムのさらなる精緻化が求められる。現時点では、測定条件の最適化や、データ解析プロセスにおける専門知識が依然として必要であり、非専門家でも容易に扱えるようなインターフェースや自動化技術の開発が、普及促進の鍵となるだろう。また、取得データの解釈性を高め、モデルの汎化性能を向上させるためのさらなる研究が必要であり、特に新たな応用分野の開拓に向けた基礎データの蓄積が課題として挙げられる。
総じて、FLAIRSは、品質管理や製品開発における効率化を支援するだけでなく、複雑な物性特性や官能特性の定量化を可能としうる革新的なツールである。その応用範囲は極めて広く、未来の産業基盤を支える中核技術となる潜在力を持つ。本研究で得られた成果を基に、FLAIRSが社会課題の解決や新たな価値創造に向けた一助となることを期待したい。
5 謝辞
医薬品を用いた真贋判定検証の実施にあたり、研究協力および助言をいただきました一般社団法人 医薬品セキュリティ研究会ならびに関係者の皆様に深く感謝申し上げます。本研究は、関係者の皆様のご支援とご協力によって成り立ったものであり、この場をお借りして心より感謝の意を表します。



