1 はじめに
乳がんは,日本人女性のかかるがんの中で最も罹患率の高いがんであり,その罹患数は年々増加している。2018年の統計では,年間9万人以上が乳がんと診断されており,女性が生涯で乳がんに罹患する割合は9人に1人と推定されている1)。乳がんは,早期発見であるほど治癒率が高いことから,定期的な検診が重要である病気のひとつとされているが,現在の日本の乳がん検診受診率は47.4%2)と先進国の中でも低いレベルに位置し,死亡数も年々増加傾向にある。
乳がん検診では,死亡率の減少が証明されている唯一の検査であるマンモグラフィー検査が基本とされている。マンモグラフィー検査は,乳腺組織の多寡によって病変の検出感度が異なることが知られており,乳腺が発達している方の場合は,検出感度が低下することが問題となっている。この乳腺が発達した乳房を「高濃度乳房」と呼び,検診のあり方を考える上で近年関心が高まっている。
一方で,マンモグラフィー検査と相補的な機能を持つ検査として,超音波検査がある。超音波検査は,マンモグラフィー検査では乳腺に隠れて描出できない病変の検出を補う有力な検査法であることが示されている3)。
日本人を含むアジア人女性では,欧米人と比較して高濃度乳房の割合が多いことから,高濃度乳房に対して,マンモグラフィー検査と超音波検査を併用して行うことを推奨する動きが国内で活発になってきている。
しかしながら,超音波検査の追加要否を決定する高濃度乳房の判定は,医師のマンモグラフィー画像における視覚評価により行われ,読影者間や読影者内の判定結果の再現性確保が課題となっている。
コニカミノルタは,このような課題に対してマンモグラフィー画像から乳房構成を客観的な指標で判定する乳房構成解析ソフトウェア「Breast Density Assessment(以下,Bda)」を開発した。これにより,再現性の高い乳房構成の判定が可能となり,乳房の特徴に合わせた乳がん検診,すなわち「個別化検診」の実現に貢献できると考えている。
2 乳房構成と主観評価における課題
2. 1 乳房構成とは
乳房は乳腺組織と脂肪組織によって構成され,マンモグラフィー検査では,乳腺は白く,脂肪は黒く描画される。また,病変は白く描画されるため,高濃度乳房の場合は病変が乳腺に隠れて見えづらく,病変の判別が難しいことが課題となっている。この病変が正常乳腺に隠されてしまう可能性の程度を示す指標が,“乳房構成”である。
乳房構成の判定方法は,日本乳がん検診精度管理中央機構(以下,精中機構)によって定められており4),乳腺組織の割合が少ないものから順に,脂肪性(fatty),乳腺散在(scatterd),不均一高濃度(heterogeneous dense),極めて高濃度(extremely dense)の4つに分類される(Fig. 1)。このうち,病変の検出が難しいとされる不均一高濃度と極めて高濃度を併せて“高濃度乳房(dense breast)”と呼んでおり,超音波検査を追加する判断のひとつとなりつつある。
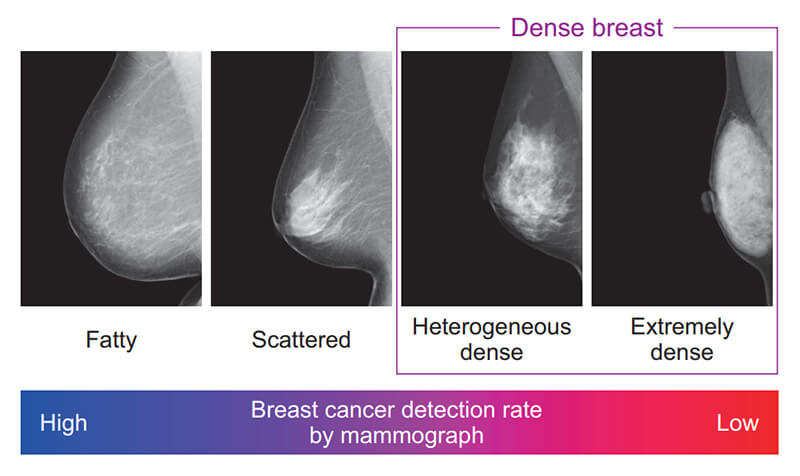
Fig. 1 Radiologists classify breast density using a 4-level density scale.
2. 2 主観評価における課題
乳房構成の判定は,読影者の定性的な視覚評価により行われている。視覚評価は,簡便な判定方法である一方,主観的な判定となり,普遍性と客観性に乏しく,判定結果が読影者や読影条件等によって異なることが知られている。このような人の目や経験では再現性高く判断することが難しい微妙な乳房構成の違いについて,客観的に判定し再現性を担保することが乳房構成を評価する上での重要な課題となっている。
3 乳房構成解析ソフトウェア(Bda)
3. 1 処理の概要
本ソフトウェアの処理フローは,精中機構のガイドラインの考え方4)に基づき,乳腺組織がもともと存在していた領域を抽出するプロセスと乳腺が現存する領域を抽出するプロセスから構成される(Fig. 2)。
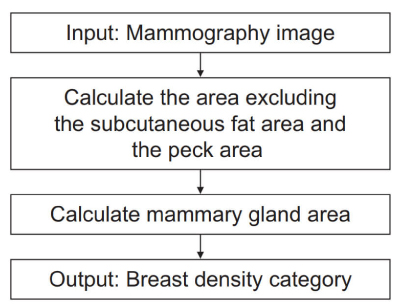
Fig. 2 Breast density assessment algorithm, consisting of two processes.
乳腺組織がもともと存在していた領域は,皮下脂肪と大胸筋部分,および,あきらかな乳腺後隙の脂肪のみの部分を除いた領域で決定される(Fig. 3 のb領域)。一方,乳腺領域(Fig. 3 のc領域)は,処理済み画像を入力画像としているために起こり得る外部因子の影響を除いた計算領域(Fig. 3 のd領域)を用いて抽出する。
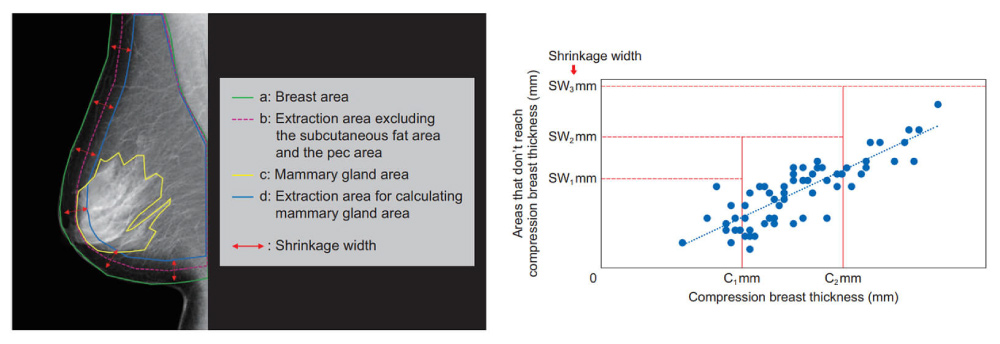
Fig. 3 Relationship between compression thickness and shrinkage width from skin line (bottom). The shrinkage width is used to identify the calculation d area.
3. 2節では,本アルゴリズムにて,ロバスト性を確保した乳腺領域抽出のために計算領域を設定した背景と処
理内容について説明する。
3. 2 ロバスト性確保のための工夫
マンモグラフィー検査で撮影された画像は,画像処理条件をはじめとし,患者の個体差(乳房の大きさ・年齢・体格等),撮影手技といった様々な外部因子の影響を受ける。特にスキンライン付近は,乳房圧迫厚に未達の領域(圧迫板にも撮影台にも接触していない領域,Fig. 4の赤矢印部分)となるため,上述の外部因子の影響が顕著に画像として表現される。そこで,乳腺領域抽出のために,乳房圧迫厚に未達の領域を除いた領域を計算領域として利用することにより,ロバスト性を確保した乳腺領域の抽出を行う設計とした。
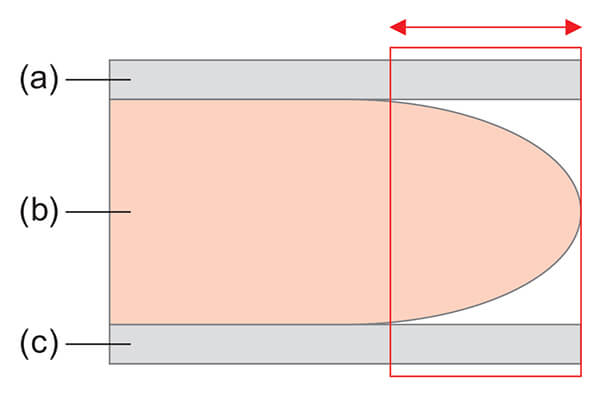
Fig. 4 Schematic diagram from the side of viewed compressing the breast (b) by a compression plate (a) and a radiographing stand (c).
まず,乳房圧迫厚に達している領域と乳房圧迫厚に未達の領域との関係を大量の臨床データより蓄積し,それを基に乳房スキンラインからの収縮幅(Fig. 3 のshrinkage width)を決定し,計算領域(Fig. 3 のd領域)を求める。そして,計算領域から乳腺領域抽出のための閾値をヒストグラム解析で算出し,乳腺組織がもともと存在していた領域(Fig. 3 のb領域)へ求めた閾値を適用することにより乳腺領域(Fig. 3 のc領域)を抽出した。
乳房構成のカテゴリーは,乳腺組織がもともと存在していた領域(Fig. 3 のb領域)における乳腺領域(Fig. 3のc領域)の割合を乳腺量とし,乳腺量から4段階のカテゴリーを算出している。また,本ソフトウェアでは乳房構成を瞬時に把握できるように,算出した4段階のカテゴリーをKMDC(konica minolta density category)スコア(脂肪性を1,散在性を2,不均一高濃度を3,極SW3mm めて高濃度を4)で表現している(Fig. 5)。
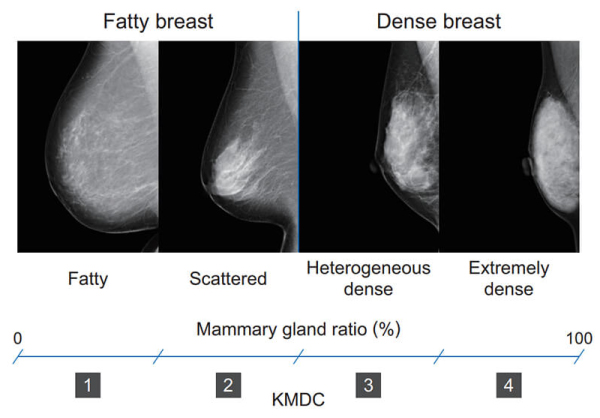
Fig. 5 Relationship between mammary gland ratio and breast density category.
3. 3 視認性を重視した判定結果の出力設計
本ソフトウェアは,当社の画像処理機能搭載ゲートウェイであるSenciafinder(センシアファインダー)に搭載される。乳房X線撮影装置で撮影された画像処理後のデータをSenciafinderが受信するとFig. 6 に示す表示スタイルで処理結果を出力する。

Fig. 6 Output image for breast density assessment. (a) KMDC (konica minolta density category) for each of the right and left breasts. (b) Percentage of mammary gland for each of the right and left breasts. (c) KMDC for the patient is higher KMDC between right and left breasts.
DICOM Secondary Capture Statement 形式で出力していることより,一般的な読影端末で表示が可能であり,施設運用に合わせたフレキシブルなシステム提案が可能なことから,導入への障壁が低いことも特徴である。
乳房構成の判定結果の表示スタイルは直感的な視認性を重視した設計であり,読影の効率化をサポートする。表示の右部に,左右乳房に対する乳房構成の判定カテゴリー(Fig. 6 (a))とそれらの乳腺割合(Fig. 6 (b))をグラフィカルに表示する。また,画像中央には左右の乳房構成のうち,より高濃度の判定カテゴリー結果をサムネイル表示で視認可能なフォントサイズで表示する(Fig. 6 (c))。
このような表示方法により,乳房構成の判定結果を瞬時に把握でき,さらに出力結果の詳細を確認することで,左右の乳房構成に関する情報を直感的に捉えることができる。
4 画像処理条件の影響について
医師の視覚評価の結果と本ソフトウェアの結果に画像処理が与える影響について,笠井ら5)の報告がある。4. 2節にその結果とそれに対する我々の考察を示す。
4. 1 使用症例・実験方法
医療法人社団 恒聖会 大塚ブレストケアクリニックにて2007年11月~ 2008年3月までに撮影されたマンモグラフィー画像(当社マンモグラフィーシステムにて撮影)の中からランダムに選択した58症例(116乳房)に対して読影で使用される範囲にて画像処理条件をFig. 7のように変更し本実験に使用した。
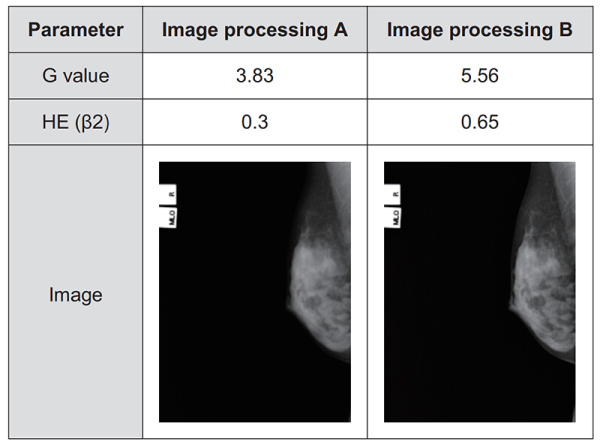
Fig. 7 Image processing parameter. Contrast is enhanced by increasing G value, and sharpness is improved by emphasizing HE (β2) processing compared with image processing A and image processing B.
画像処理Aと画像処理Bのデータ群を1 ヶ月のWashout期間を設けて医師(乳腺外科医)1名による乳房構成判定を実施し,4段階の乳房構成と乳腺量を回答いただいた。そして,対象症例に対して医師の判定結果と本ソフトウェアの判定結果をそれぞれ比較評価した(Fig. 8)。
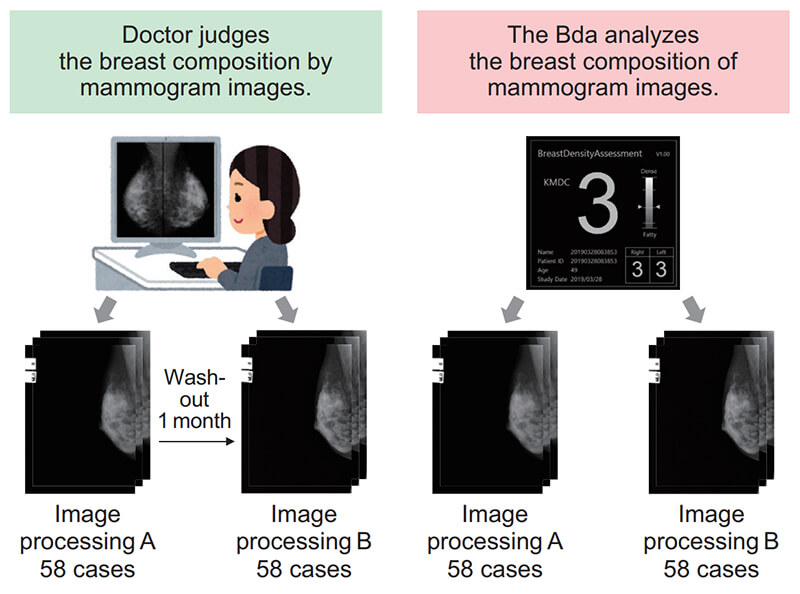
Fig. 8 Evaluation method of doctor’s judgment result and Bda analysis result in different image processing.
4. 2 結果・考察
医師の判定と本ソフトウェアの判定はともに,画像処理Aと比較して画像処理Bのほうが“脂肪性寄り”という結果であった(Fig. 9)。
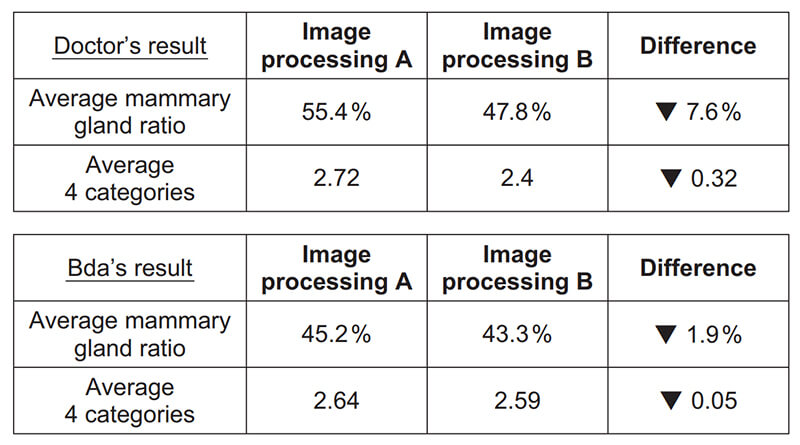
Fig. 9 Result of average mammary gland ratio and average breast density category (4 categories).
画像処理の違いによる判定結果の違いを顕在化させるため,個々の症例について,画像処理 Bの乳腺量から画像処理Aの乳腺量を引いた“乳腺量の変化”について考察を行った(Fig. 10)。
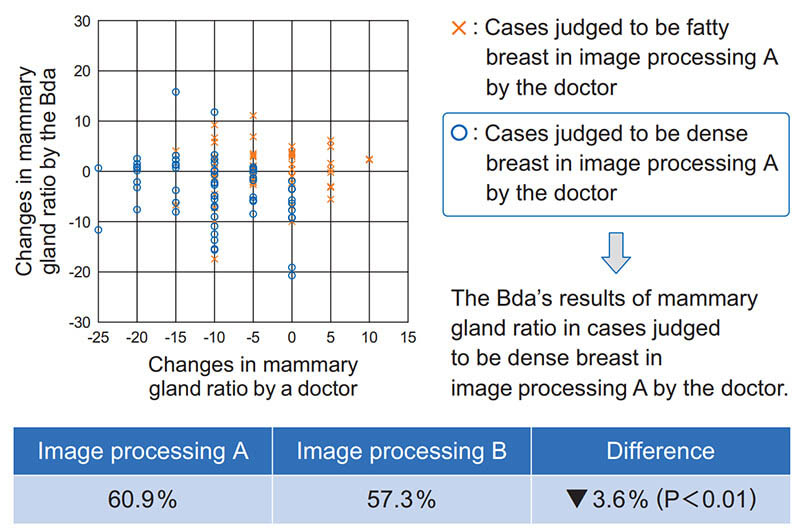
Fig. 10 Result of changes in mammary gland ratio between image processing A and B. The horizontal axis is the change in mammary gland ratio of the doctor, and the vertical axis is the change in mammary gland ratio by the Bda.
その結果,画像処理Aにおいて医師が“高濃度乳房”と判定した症例は,画像処理Bでは医師の判定および本ソフトウェアの判定ともに“脂肪性寄り”という結果であった。一方,画像処理Aにおいて医師が“脂肪性”と判定した症例において,画像処理Aと画像処理Bとで“乳腺量の変化”に顕著な違いは見られなかった。
“高濃度乳房”の症例に対する本ソフトウェアの中間処理結果の画像をFig. 11 に示す。画像処理Bの画像において,本ソフトウェアが“脂肪”と判定した領域が増えたことがわかる。この中間処理結果より,画像処理Aにおいて医師が“高濃度乳房”と判定した症例について,画像処理Bでは医師も本ソフトウェアもともに“脂肪寄り”と判定したと推測される。一方,画像処理Aにおいて医師が“脂肪性”と判定した症例において,画像処理AとBとの間で“乳腺量の変化”に顕著な違いが認められなかった理由は,“脂肪性乳房”の場合は濃度方向の値が乏しいため,画像処理の影響を受けにくいことによるものと考えられる。
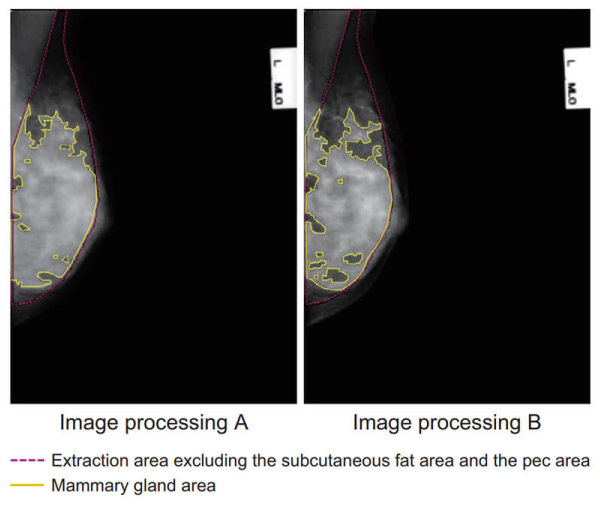
Fig. 11 Result of mammary gland area segmentation between image processing A and B.
これらの結果および考察より,本ソフトウェアは画像処理条件が異なる症例についても,適切に乳房構成の判定ができることが確認された。また,読影者の感覚に合う納得性のある乳房構成の判定ができていることから医師の読影を支援できる可能性が示唆された。
5 まとめ
マンモグラフィー画像から乳房構成を客観的な指標で判定する乳房構成解析ソフトウェア「Breast Density Assessment(Bda)」を開発した。本ソフトウェアを利用することにより,従来困難であった再現性の高い乳房構成の判定が可能となり,各人の乳房の特徴に合わせた乳がん検診, すなわち「個別化検診」の実現に貢献できると考える。
コニカミノルタは,今後も個別化検診をサポートすることで,一人ひとりにとって乳がん検診をよりよいものにし,乳がんの早期発見と治癒率向上に貢献していく所存である。



