1 はじめに
アミロイドとは,タンパク質のミスフォールディングによって生じる異常な線維タンパクである。アミロイドは,クロスβシート構造を有しており,コンゴレッド色素と特異的に結合する点や,熱や酵素処理に対して強い耐性を有するなど,正常な生体タンパク質とは異なる性質を有する。
アミロイドが局所あるいは全身に蓄積することにより様々な臓器に障害をきたすアミロイドーシスが生じる。アミロイドーシスは人や動物の進行性の難治性疾患であり,原因となるタンパク質毎にアルツハイマー病やパーキンソン病など36病型が存在している。アミロイドーシスの患者数は年々増加傾向にあり,早期の診断が求められている。
アミロイドの検出は,主に病理組織学的検索法が用いられているが,評価には十分な習熟が必要であり検査には数日を要するためアミロイドの検出に時間がかかるという課題がある1)。その他の方法には,放射性同位体プローブを用いたアミロイドPETなどが挙げられるが,この方法も評価に十分な習熟が必要であり,さらに大がかりな機器が必要で検査費が高額になるなどの課題がある。
また,アミロイドの検出は,食肉衛生の観点からも重要な課題であることが示されている2)。食肉中のアミロイド検出においては,簡易に迅速に検出する方法が求められている。
そこで我々は,簡易に迅速にアミロイドを検出する手法の確立を目標として非標識蛍光イメージング手法の開発に取り組んだ。
2 実験装置
Fig. 1 に実験装置の概念図を示す。
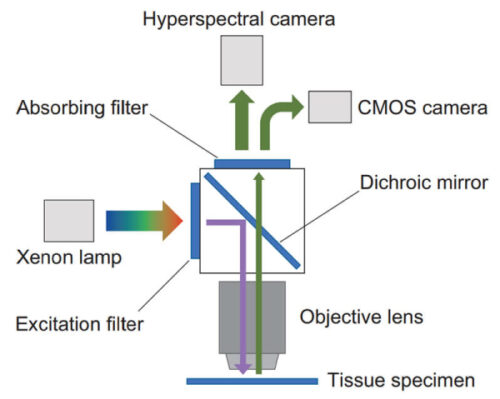
Fig. 1 Conceptual diagram of experimental equipment.
Fig. 1 に示す実験装置は,蛍光顕微鏡(オリンパス製BX50)にハイパースペクトルカメラ(エバジャパン製NHシリーズ)と光源装置(朝日分光MAX-350)を接続した状態を基本形態としている。
光源装置は,キセノンランプ 300 Wを使用しており,内部のミラーモジュールは同社製UV-VISを使用している。この構成により300 nmから600 nmの光を照明光,および励起光として利用できる。光源装置の内部には個別に光学フィルターを挿入することができ,必要に応じて波長を選択して照射することができる。なお,光源は蛍光顕微鏡の落射照明ユニットへ石英ライトガイドを用い接続している。
ハイパースペクトルカメラの基本仕様は,画像解像度1000×1000(100万画素),測定波長範囲350 nmから1000 nm,波長分解能5 nmである。ハイパースペクトルカメラは蛍光顕微鏡の三眼鏡筒へCマウントカメラアダプター(オリンパス製U-DPCAD)を介して接続する。ハイパースペクトルカメラは波長ごとの画像を取得できるが,カラー画像の取得はできないため,カメラの光路切り替え機構を追加しCMOSカラーカメラにより明視野カラー画像も撮影できる構成としている。
明視野カラー画像を取得することで,病理学的見地によるアミロイドの識別結果と比較し測定結果の確からしさを検証する事ができる。また,蛍光顕微鏡の蛍光ユニットを適切に選定する事で観察対象からの蛍光のみを観察することができる。
3 事前検証および測定手順
今回の観察においては,事前に対象のアミロイドの精製を行い,精製したアミロイド溶液を蛍光分光光度計(例えば日本分光製FP8300)で測定し励起蛍光マトリックスを取得している。取得したデータを分析,または目視により注目すべき励起波長と蛍光波長の組み合わせを選定する。検出対象の自家蛍光パターンが明らかになっていない場合は,事前検証として詳細な励起蛍光マトリックス情報を取得する必要がある。
その後,実際に観察したい部位の組織切片から組織標本を作製する。測定の際はまず白色照明による明視野環境下で組織標本を観察し,アミロイドを検出したい場所を選定する。次に事前検証によって選定していた励起波長と蛍光波長が取得できるように蛍光ユニットや照明光源の波長フィルターなどを変更し,目視による蛍光観察,さらにはハイパースペクトルカメラによる蛍光画像を取得する。
ハイパースペクトルカメラで撮影した画像データの解析には機械学習の一種である主成分分析(PCA)を用いた。
4 観察結果および考察
4. 1 リスザル脳のアミロイドβの可視化の例
アミロイドβを非標識蛍光イメージングにより可視化した例としてリスザル脳について述べる。
東京農工大学村上智亮准教授らの実験から,リスザル脳のアミロイドβは励起光450 nm,蛍光485 nmに特徴的な蛍光スペクトルが現れることが分かっている。東京農工大学所有の組織標本をハイパースペクトルカメラで撮影を行った後,取得した画像データをPCAにより解析し,アミロイドβの検出を試みた。Fig. 2 はPCAを行いアミロイドβと赤血球を可視化したものである。
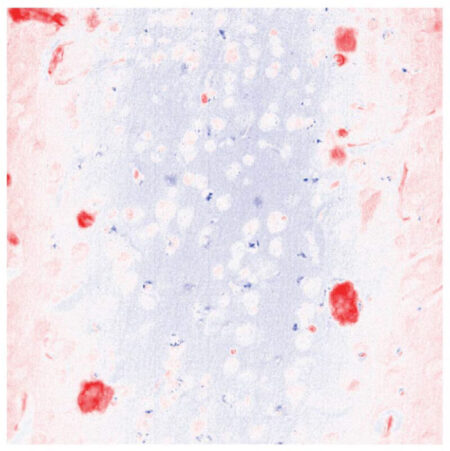
Fig. 2 PCA Score of Amyloid β in Squirrel Monkey brain.
赤い斑点はアミロイドβを示し,青点は赤血球を示している。励起光源にはキセノンランプを使用し,蛍光ユニットにオリンパス製U-MWBV2を用い400 nmから440 nmで励起する条件とした。組織標本の観察およびハイパースペクトルカメラの撮影には顕微鏡対物レンズにオリンパス製UPlan Fl 20倍NA0.50を使用しており,ハイパースペクトルカメラの撮影範囲は約300×300 μmである。ハイパースペクトルカメラは画像上部から1画素分のラインにデータを取得する構成となっており撮影条件としてラインの送り速度を受光量に応じて設定する必要がある。今回の測定は5 Line/sec.であり撮影にかかる時間は200秒である。
Fig. 3 はハイパースペクトルカメラで撮影した画像を波長ごとに並べたものである。アミロイドβは数10 μm程度の粒子状に凝集しており,Fig. 3 の丸枠で示したように約470 nmから530 nmの波長領域に波長成分を持ち,480 nmから490 nmで最も強い蛍光を発している。アミロイドβの周囲の小さな輝点は赤血球であり,アミロイドβ同様に蛍光を発している。しかし,アミドイドβよりも長波長領域の蛍光スペクトルを持つため,その波長分布の差によってアミドイドβと分離できた例である。
PCAの結果からアミロイドβの分離に寄与している波長は,約485 nmであり,分光蛍光光度計による測定結果から予測していた蛍光波長とほぼ一致している事が確認できた。以上の結果から,非標識蛍光イメージングの原理確認が出来たと考えている。

Fig. 4 は自家蛍光の観察画像,PCA結果,コンゴレッド染色後の蛍光観察画像の比較例である。撮影場所を変えた場合でも,アミロイドβが凝集している様子を確認することができる。
Fig. 4 の上段の画像は各観察位置の自家蛍光の観察画像である。画像中の青く光っている斑点部がアミロイドからの自家蛍光である。この画像は一般的なカメラで撮影したカラー画像である。カラー画像で撮影場所を選定し,その後に撮影光路を切り替えてハイパースペクトルカメラで撮影する。中段の画像はハイパースペクトルカメラで撮影した画像のPCA結果を画像として表示したものである。赤の斑点部がアミロイドとして検出した箇所である。下段の画像はコンゴレッド染色した後の組織標本の蛍光観察画像であり,明るい斑点部がアミロイドβが染色された箇所である。それぞれの画像を比較するとPCAによって検出した箇所がコンゴレッド染色後の蛍光観察画像とよく一致している様子が分かる。
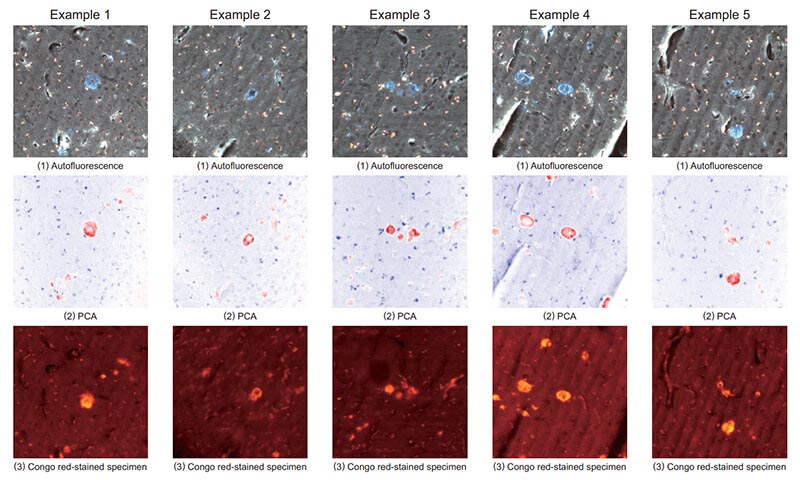
Fig. 4 Comparative example.
4. 2 フラミンゴ脳のアミロイドβの可視化の例
次に,フラミンゴ脳のアミロイドβを非標識蛍光イメージングにより可視化した例を示す。
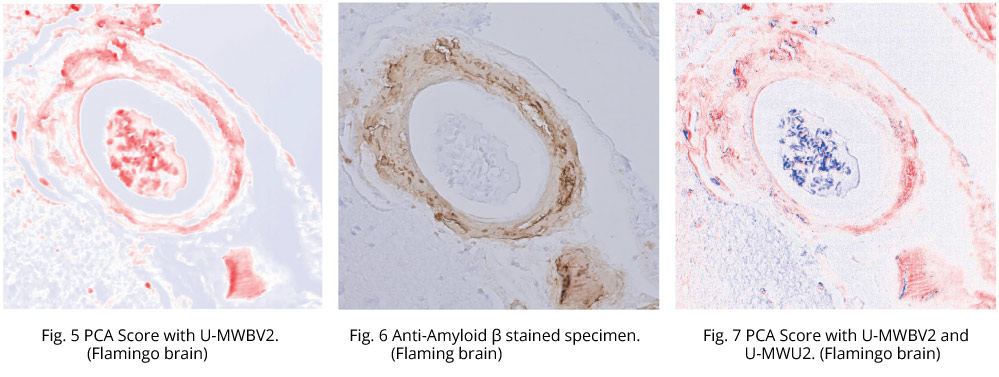
フラミンゴ脳アミロイドβも,リスザル脳のアミロイドβと同様に励起光源はキセノンランプを使用し,蛍光ユニットはオリンパス製U-MWBV2とU-MWUV2の2種類の蛍光ミラーユニットを用い,それぞれの条件で観察およびハイパースペクトルカメラでの撮影を行った。Fig. 5 は蛍光ミラーユニットU-MWBV2を使用し,ハイパースペクトルカメラで撮影した画像のPCA結果であり,画像の赤い部分がアミロイドと判定した箇所である。
Fig. 6 は同組織標本の抗アミロイドβ免疫染色の画像であり,アミロイドが沈着している場所が茶色く染まっている。Fig. 5 とFig. 6 を比較すると画像中央部において染色されていない領域を,Fig. 5 のPCAの結果ではアミロイドであると判定している。染色された場所の自家蛍光とそれ以外の場所の自家蛍光の波長分布が類似していたため,差異を検出できなかったものと推測される。
Fig. 7 はU-MWBV2とU-MWU2の2種類の蛍光ミラーユニットを使用し,それぞれの条件で撮影した2つの画像を用いてPCAを行った結果である。画像中央部の検出結果が改善され,Fig. 6 の画画像とよく一致している様子が分かる。2種類の異なる蛍光ミラーユニットを用い,それぞれの条件で撮影した2つの画像を組合せることにより情報量が増えたことがアミロイドβの分離に寄与したものと考えられる。このように,検出したい対象と周囲との差異が小さい場合は,複数の条件で画像取得しPCAに使用すると効果的である。
4. 3 まとめ
リスザル脳,フラミンゴ脳のアミロイドβを蛍光観察で検出できることが確認できた。また,ハイパースペクトルカメラ画像をPCAにより解析する環境構築ができた。
4. 4 非標識蛍光イメージングの課題
アミロイドの非標識蛍光イメージングを通して抽出した課題は,大きく次の4点である。
(1)自家蛍光が弱い
(2)紫外線領域の励起波長が必要
(3)スペクトル分離の精度
(4)データハンドリング
1つ目の課題に対しては,検出するために十分な蛍光を発光させるために照射する励起光の光量を上げる,もしくはハイパースペクトルカメラの検出感度を上げるという2通りのアプローチが考えられる。前者は半導体レーザーを光源に用いることが効果的と考えている。リスザル脳のアミロイドβに適した励起波長は450 nmであり,出力が1 W前後の市販の半導体レーザー製品が使用できる可能性がある。後者は,たとえばセンサーサイズの大きなセンサーを選択する,あるいはビニング処理などが有効と考えられる。アミロイドβに関しては数10~ 100 μm程度の凝集を検出できれば良いと考えると,今回使用したセンサーを適用する場合は5ピクセル程度のビニング処理を実施した場合でも十分な分解能で撮影が可能と考えられる。また,ビニング処理は4つ目の課題に対しても同時に効果的な手法である。
2つ目の課題については,キセノンランプは紫外領域の波長成分を持っており,光源出力も高いことから光量自体は十分あると考えている。しかし,一般的な光学材料は約400 nm以下の波長になると急激に透過率が低下するため,顕微鏡光学系の光量損失が課題となる。そのため,たとえば250 nmから300 nm程度の励起波長が必要となる場合は十分な光量を確保することが困難になる。また蛍光の取り込みも同様に困難になる。このような対象サンプルの測定には紫外対物レンズを用いるなどの対策が有効と考えられる。
3つ目の課題に対しては,スペクトル成分の分離方法としてはPARAFACが有効であると考える3)。また,分析に使用しない波長領域の情報を排除するために,顕微鏡にセットする蛍光ユニットの各フィルターを観察対象に応じて選定することが有効である。
4つ目の課題に対しては,データ量の圧縮がポイントとなる。現状は,ある1つの励起波長に対してハイパースペクトルカメラの画像データ量は250 MB/枚である。励起波長を掃引する場合や連続撮影を行うは場合には,非常に膨大なデータ量となる。しかしながら,アミロイドは特異的な自家蛍光パターンを有することが分かっているため,予めいくつかの撮影条件を決めておき,特定条件の撮影のみからアミロイドの沈着領域を検出できる可能性がある。その場合は,ハイパースペクトルカメラの代わりに一般的な産業用カメラと光学フィルターを配置すればよく,装置の簡易化と装置の低コスト化に大きく寄与することが期待される。
5 課題と今後の展望
今後は,コンゴレッド染色した組織標本の観察画像と,PCAの結果をより詳細に比較し,検出結果の妥当性について検証を進めていく予定である。
また,並行して動物種や対象臓器を増やしデータ蓄積を進めていく予定である。将来は検出に関する装置面と検出アルゴリズムの標準化へ繋げていきたいと考えている。
6 謝辞
東京農工大学農学研究院動物生命科学部門村上智亮准教授には,本開発を進めるにあたり,サンプルの提供や解析に関してご協力,ご助言をいただきました。この場を借りて御礼申し上げます。



